植物葉綠體DNA提取試劑盒
|
產(chǎn)品編號(hào)
|
產(chǎn)品名稱(chēng)
|
包裝
|
|
RTU5003
|
植物葉綠體DNA提取試劑盒
|
50次
|
● 產(chǎn)品簡(jiǎn)介:
葉綠體(Chloroplast)是質(zhì)體的一種, 是高等植物和一些藻類(lèi)所特有的能量轉(zhuǎn)換器,是光合作用的反應(yīng)場(chǎng)所���。在高等植物中葉綠體為雙凸或平凸透鏡,長(zhǎng)徑5~10μm�����,短徑2~4μm,厚2~3μm���。高等植物的葉肉細(xì)胞一般含50~200個(gè)葉綠體��,可占細(xì)胞質(zhì)的40%����,葉綠體的數(shù)目因物種細(xì)胞類(lèi)型����,生態(tài)環(huán)境,生理狀態(tài)而有所不同�。葉綠體由葉綠體外被(chloroplast envelope)、類(lèi)囊體(thylakoid)和基質(zhì)(stroma)三部分組成��,含有3種不同的膜:外膜�����、內(nèi)膜����、類(lèi)囊體膜和3種彼此分開(kāi)的腔:膜間隙、基質(zhì)和類(lèi)囊體腔�。
葉綠體DNA(Chloroplast
DNA���,cpDNA),存在于葉綠體內(nèi)���,高等植物葉綠體的DNA為雙鏈共價(jià)閉合環(huán)狀分子�,其長(zhǎng)度隨生物種類(lèi)而不同���,其大小在120 kb到217 kb之間�����,相當(dāng)于噬菌體基因組的大小雙鏈環(huán)狀,一個(gè)葉綠體含有10~50個(gè)cpDNA����。
本試劑盒是結(jié)合植物葉綠體純化試劑盒和離心柱式植物DNA提取試劑盒而推出的新產(chǎn)品,專(zhuān)門(mén)用于植物葉綠體DNA的快速提取����。
1.
純度高,不含污染和抑制劑���,可以直接用于酶切�、PCR、real-time
PCR�����、
multiplex PCR���、RAPD���、RFLP、AFLP�、Southern
Blotting, microsatellite analysis等各種后續(xù)分子生物學(xué)實(shí)驗(yàn)。
2.
以每次處理30
g葉片計(jì)算���,本產(chǎn)品可使用8-10次提取植物葉綠體���,每次能得到3-5
mg左右葉綠體。按照每次使用0.2
ml 葉綠體溶液計(jì)算�����,可以至少提取50次葉綠體DNA的純化���。cpDNA
產(chǎn)率一般在1-2
μg/1 g葉片樣品����。OD260/280一般在1.8以上。DNA片段長(zhǎng)度一般在40-50
Kb左右�����。
3.
已經(jīng)成功用于菠菜��,大豆�����,萵筍�����,白菜�,煙草和甜菜等雙子葉植物�,也適用于單子葉等其他植物(可能需要優(yōu)化條件)。
● 貯存及運(yùn)輸:
4-8℃保存��,至少一年有效�����;試劑盒常溫運(yùn)輸。
● 產(chǎn)品組成:
|
產(chǎn)品貨號(hào)
|
產(chǎn)品名稱(chēng)
|
包裝
|
貯存
|
|
RTU5003-01
|
葉綠體提取緩沖液(5×)
|
2×250
ml
|
4-8℃
|
|
RTU5003-02
|
密度梯度分離試劑
|
65
ml
|
4-8℃
|
|
RTU5003-03
|
BSA
|
3
g
|
4-8℃
|
|
RTU5003-04
|
1
M DTT(粉末裝)
|
2.5
ml
|
4-8℃
配制后-20℃貯存
|
|
RTU5003-05
|
過(guò)濾紙
|
50張/包
|
RT
|
|
RTU5003-06
|
葉綠體DNA提取緩沖液AP1
|
25
ml
|
RT
|
|
RTU5003-07
|
葉綠體DNA提取緩沖液AP2
|
10
ml
|
RT
|
|
RTU5003-08
|
葉綠體DNA提取緩沖液AP3(濃縮液)
|
15
ml
|
RT
|
|
PW-25ml
|
漂洗液PW(濃縮液)
|
25
ml
|
RT
|
|
RNaseA-0.5ml
|
RNase A(10 mg/ml)
|
0.5
ml
|
-20℃
|
|
EB-15ml
|
洗脫緩沖液EB
|
15
ml
|
RT
|
|
CG-50
|
吸附柱CG(白色)
|
50個(gè)/包
|
RT
|
|
CT-50
|
收集管
|
50個(gè)/包
|
RT
|
|
|
說(shuō)明書(shū)
|
一份
|
-
|
● 使用說(shuō)明:
一 植物葉綠體提?����。?span>
注意:葉綠體對(duì)溫度高度敏感���,所以整個(gè)操作必須在冰上或者在冷室進(jìn)行��,所用器皿和溶液均需要在4℃預(yù)冷���。葉綠體提取過(guò)程中離心時(shí)一定要在4℃進(jìn)行,離心力以g而不是rpm計(jì)算�。如果需要研究葉綠體的功能,提取過(guò)程還需要在昏暗的光線條件下進(jìn)行�����。
需要自備材料:
剪刀�����;50
ml尖底或圓底離心管�;15
ml尖底或圓底離心管;漏斗���;勻漿機(jī)����;低溫離心機(jī)。
1.1 材料預(yù)處理:
實(shí)驗(yàn)前1-2天將植物放在暗室培養(yǎng)以減少葉綠體中淀粉顆粒的形成�,否則離心時(shí)這些顆粒很容易使葉綠體破裂。葉片在實(shí)驗(yàn)前需先用自來(lái)水洗凈�,再用蒸餾水淋洗,去掉多余水分���。如果葉片采集后不能立即處理����,則保存時(shí)需要保持葉片濕潤(rùn)����,即使如此,葉片采集后的放置時(shí)間也不能超過(guò)一天��。
1.2
1×葉綠體提取緩沖液(即用型)配制:
|
|
1×葉綠體提取緩沖液(即用型)
配制量200 ml
|
|
葉綠體提取緩沖液(5×)
|
40 ml
|
|
BSA
|
0.2 g
|
|
1 M DTT
|
200 μl
|
|
滅菌水
|
定容至200 ml
|
|
|
冰上預(yù)冷待用�����,現(xiàn)用現(xiàn)配����,不建議貯存
|
注:一個(gè)30克樣品提取反應(yīng)需要 150 ml 1×葉綠體提取緩沖液(即用型)。
1.3 葉片勻漿:
1.3.1 新鮮采集植物葉片�,快速去除葉脈(約30克)并將葉片剪成1-3 cm2大小的碎片并浸泡在150 ml的預(yù)冷的1×葉綠體提取緩沖液(即用型)中(每克葉片加5 ml)。
1.3.2 將浸泡了葉片的溶液轉(zhuǎn)移到勻漿機(jī)(貨號(hào):RT-2243A)中���,低速勻漿10秒��,避免起泡沫����。用玻璃棒把液面的碎片按入勻漿機(jī)底部后��,再低速勻漿10秒�����,重復(fù)10秒勻漿3-4次至葉片破碎即可��,不要過(guò)分勻漿�����,否則會(huì)降低完整葉綠體的得率。
1.3.3 用2層過(guò)濾紙置于小漏斗上���,將勻漿液過(guò)濾收集到預(yù)冷的250 ml量筒中�����,一般更換三次濾紙可收集約120 ml濾液��,將濾液等分到4個(gè)預(yù)冷的50 ml的塑料離心管中(每個(gè)管中的濾液不要超過(guò)35 ml)�。
1.4 離心去雜質(zhì):
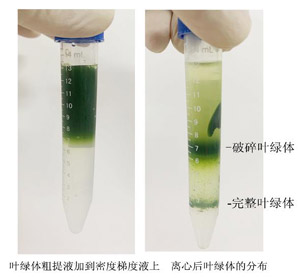
4℃ 200 g離心5分鐘��,保留上清��,沉淀為未破裂植物組織�、細(xì)胞或細(xì)胞核(下圖);如果樣品中淀粉含量較高�,沉淀可能為白色。
注:此步驟用低速離心去除雜質(zhì)����,不能省略,否則得到的葉綠體DNA中會(huì)有核基因組的污染����。

1.5 收集葉綠體粗提液:
1.5.1將步驟1.4得到的上清液平分到4個(gè)預(yù)冷的50 ml塑料離心管中��;4℃ 1100 g離心15分鐘,小心棄上清����,沉淀含葉綠體,呈深綠色(下圖)�。

1.5.2 在沉淀中加入1.5 ml 預(yù)冷的1×葉綠體提取緩沖液(即用型),手彈離心管底部使葉綠體重懸�����,收集4管溶液(約6 ml)��,此溶液即為葉綠體粗提產(chǎn)物����。
1.5.3 如果對(duì)葉綠體DNA是否含細(xì)胞核DNA的要求不高,則葉綠體粗提液可以直接用于葉綠體DNA純化(步驟2.1)���。
1.6 完整葉綠體的純化:
葉綠體重懸液配制
|
|
葉綠體重懸液
|
|
|
配制量20 ml
|
|
葉綠體提取緩沖液(5×)
|
4 ml
|
|
滅菌水
|
16 ml
|
|
|
冰上預(yù)冷待用���,現(xiàn)用現(xiàn)配,不建議貯存
|
1.6.1 單梯度分離法(適合菠菜����,白菜�,萵苣�,擬南芥,綠蘿等):
1.6.1.1 40%密度梯度液配制-10 ml:
在15 ml離心管中加入6 ml 1×葉綠體提取緩沖液(即用型)和4 ml密度梯度分離試劑��,充分混合均勻���,得40%密度梯度液���,冰浴備用。
1.6.1.2將10 ml 40%密度梯度液平分到2個(gè) 15 ml離心管中����,每管5 ml;將步驟1.5.2得到的葉綠體粗提液3 ml小心鋪在5 ml密度梯度液之上�;另一管重復(fù)。(5 ml 40%密度梯度液用可以分離3 ml 葉綠體粗提液�,其他體積以此比例換算)。
1.6.1.3 4℃ 3200 g離心30分鐘�,綠色沉淀為完整葉綠體(下圖)。
注:如果最上層的分離試劑不夠清亮��,可以延長(zhǎng)離心20分鐘����。

1.6.1.4 小心棄上清�����,保留沉淀,每管沉淀中加入1 ml 葉綠體重懸液�,輕柔重懸,可以收集到2 ml完整葉綠體溶液�����。
1.6.1.5 此葉綠體溶液可以提取得到無(wú)細(xì)胞核DNA污染的葉綠體DNA
(步驟2.1)�����。
1.6.2雙梯度分離法(適合煙草��,甜菜��,豌豆等):
1.6.2.1 80%密度梯度重液配制-4 ml:
在15 ml離心管中加入0.8 ml 1×葉綠體提取緩沖液(即用型)和3.2 ml 密度梯度分離試劑�����,充分混合均勻���,得80%密度梯度重液�����。
1.6.2.2 40%密度梯度輕液配制-8 ml:
在另一15 ml離心管加入4.8 ml 1×葉綠體提取緩沖液(即用型)和3.2 ml 密度梯度分離試劑�,充分混合均勻,得40%密度梯度輕液���。
1.6.2.3 取一只15 ml離心管����,加入1.86 ml 80%密度梯度重液����,隨后取3.74 ml 40%密度梯度輕液小心鋪在80%密度梯度重液之上,冰浴備用���;然后取步驟1.5.2得到的3 ml葉綠體粗提液小心鋪在密度梯度輕液之上�����。另一管重復(fù)����。
注:每5.6 ml
40%/80%密度梯度液可以分離3 ml 葉綠體粗提液;其他體積按照比例調(diào)整�。
1.6.2.4 4℃ 3200 g離心30分鐘,上層綠色帶含破碎的葉綠體���、線粒體和核糖體等�,重液和輕液間的綠色帶為完整葉綠體(下圖)���。
注:如果最上層的分離試劑不夠清亮,可以延長(zhǎng)離心20分鐘��。
1.6.2.5 重懸葉綠體:
用廣口吸管小心將重液和輕液之間的綠色帶(完整葉綠體)轉(zhuǎn) 移到新的15 ml離心管中��,加入三倍體積預(yù)冷的葉綠體重懸液�,輕柔混勻。
1.6.2.6 離心收集葉綠體:
4℃ 1750 g離心6分鐘��,小心將上清倒出后�����,在綠色的葉綠體沉淀中加入預(yù)冷的1 ml葉綠體重懸液�����,手指輕彈管底使葉綠體重懸。最終可以收集到2
ml完整葉綠體溶液���。
1.6.2.7此葉綠體溶液可以提取得到無(wú)細(xì)胞核DNA污染的葉綠體DNA(步驟2.1)��。
1.7 葉綠體貯存:
葉綠體可在顯微鏡下檢查葉綠體完整性���。葉綠體重懸液避光-80℃保存。葉綠體必須盡快使用�����,否則非常容易失去活性��。
1.8 葉綠素含量測(cè)定:
通常葉綠體含量用單位葉綠素含量來(lái)表示����,即x
mg 葉綠素/ml 葉綠體懸浮液。
1.8.1
取10 μl 葉綠體懸浮液加入到990
μl 80%丙酮溶液中��,混勻���。
1.8.2
3000 g 離心5分鐘�����,取上清測(cè)定OD652 吸光值�,用80%丙酮做空白對(duì)照。
1.8.3
根據(jù)以下公式計(jì)算葉綠素:
葉綠素濃度(mg/ml)=(OD652×100)/36
100:稀釋倍數(shù)
36:extinction
coefficient in ml/cm·mg
二 葉綠體DNA提?�。?/b>
注:以下離心操作可以常溫下進(jìn)行�����。
2.1
取0.2-0.4 ml葉綠體溶液�����,3500 g離心2分鐘�����,小心棄上清����,沉淀為葉綠體���。
注:可以根據(jù)提取的葉綠體濃度大體估算提取到的cpDNA濃度����。經(jīng)驗(yàn)值:每50
μg 葉綠體(葉綠素濃度)可以提取到1μg
cpDNA。
2.2葉綠體沉淀中加入400 μl 緩沖液AP1和6 μl RNaseA (10mg/ml)�,漩渦震蕩1分鐘。
2.3
將離心管放在65℃水浴10分鐘���,水浴過(guò)程中顛倒離心管以混合樣品數(shù)次����。
2.4
加入130 μl 緩沖液AP2��,顛倒混勻�,冰浴5分鐘。
2.5 12,000 rpm離心5分鐘���,保留上清�,上清通常為無(wú)色����,沉淀為綠色。注:此步驟離心去除去垢劑�����,蛋白以及多糖等雜質(zhì)。
2.6 將上清(通??扇〉?00 μl)轉(zhuǎn)移到1.5 ml離心管中,加入1.5倍體積(例如400 μl的上清液加600 μl)緩沖液AP3(使用前請(qǐng)注意是否已經(jīng)加入無(wú)水乙醇)���,立即顛倒混勻�����,簡(jiǎn)短離心以去除管蓋內(nèi)壁的水珠�����。
2.7吸取步驟2.6中的混合液加入到吸附柱CG中(吸附柱放入收集管中)��,12,000 rpm離心1分鐘���,倒掉廢液,吸附柱CG放回收集管中����。
注:離心吸附柱的最大容積是700 μl����,如果一次不能完全上柱,可以分次上柱離心,保證全部溶液全部加到離心柱中��。
2.8向吸附柱CG中加入700
μl漂洗液PW(使用前請(qǐng)先檢查是否已加入無(wú)水乙醇)�,12,000 rpm離心1分鐘,倒掉廢液�,吸附柱CG放入收集管中。
2.9向吸附柱CG中加入500
μl漂洗液PW(使用前請(qǐng)先檢查是否已加入無(wú)水乙醇)�,12,000 rpm離心1分鐘,倒掉廢液���,吸附柱CG放入收集管中�����。
2.10將吸附柱CG放回廢液收集管中���,12,000 rpm離心2分鐘。
注:此步驟非常重要�,目的是將吸附柱中殘余的漂洗液去除。漂洗液中乙醇的殘留會(huì)影響后續(xù)的酶反應(yīng)(酶切�、PCR等)實(shí)驗(yàn)。
2.11將吸附柱CG轉(zhuǎn)入一個(gè)干凈的1.5ml離心管中�,向吸附膜的中間部位懸空滴加50-100
μl經(jīng)65℃水浴預(yù)熱的洗脫緩沖液EB,室溫放置2分鐘����,12,000
rpm g離心2分鐘��。
注:洗脫緩沖液體積不要少于50 μl�����,體積過(guò)小影響回收效率��;洗脫液的pH值對(duì)于洗脫效率有很大影響��。若用水做洗脫液應(yīng)保證其pH值在7.0-8.5范圍內(nèi)�����,pH值低于7.0會(huì)降低洗脫效率�。
2.12 葉綠體DNA產(chǎn)物-20℃保存����。
三 實(shí)驗(yàn)示例:
3.1 葉綠體提取示例:
30克綠蘿葉片,加入150
ml 1×葉綠體提取緩沖液(即用型) 勻漿5×10秒�����,3次過(guò)濾共收集120
ml過(guò)濾液���,平分4管��,4℃ 1100
g 離心15 min����,棄上清���,每管重懸于1.5
ml 1×葉綠體提取緩沖液(即用型)中���,共得到6
ml 葉綠體粗提液。2×3
ml 粗提液平鋪于2×5
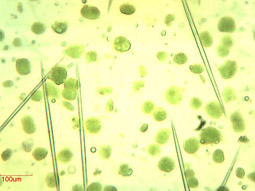
ml 40%密度梯度液之上����,4℃ 3200 g離心15分鐘,棄上清��,每管沉淀重懸于1 ml 葉綠體重懸液中�����,共得到2 ml精制葉綠體重懸液����,測(cè)定葉綠素含量為3.43 mg/ml重懸液�����。30克葉片提取得到6.86 mg葉綠體�����。取10
μl葉綠體溶液稀釋20倍����,取50 μl稀釋液顯微鏡40倍物鏡觀察���,如下圖�。
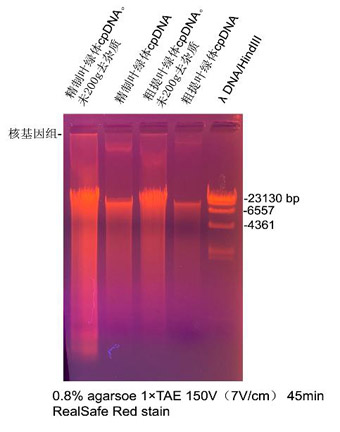
3.2 葉綠體DNA電泳示例:
葉綠體提取同3.1���。取100 μl葉綠體重懸液��,提取cpDNA���,最后用50
μl洗脫,上樣5 μl����,電泳結(jié)果見(jiàn)下圖左二泳道�,cpDAN大小約20kb����,無(wú)可見(jiàn)核基因組污染����。